Escherichia coli es un bacilo recto gram negativo con gran repercusión a nivel industrial, clínico, y biotecnológico, es por esto que el entendimiento del comportamiento de esta bacteria es clave para el desarrollo en el ámbito de la investigación. Con este fin, se emplearon los métodos de la turbidimetría y el plaqueo para la determinación de la curva de crecimiento de E. coli. De la misma forma, se sometió a la bacteria a distintos parámetros metabólicos como la presencia de lactosa y la ausencia de oxígeno, algunos externos como la acción de SDS (detergente), NaCl y la Amoxicilina (antibiótico), y también variaciones de pH y temperatura. En este sentido, se calculó el tiempo generacional de la muestra bacteriana empleando el método de McFarland y se reportaron las curvas de crecimiento en cada ocasión. Se concluyó que todos los parámetros evaluados son capaces de retardar e incluso inhibir el crecimiento de la muestra de E. coli y que el tiempo generacional según los datos tomados, es de 23 minutos.
1. INTRODUCCIÓN
A diferencia de otros organismos, en los cuales el crecimiento implica un aumento de tamaño, el crecimiento bacteriano está más relacionado al número de individuos que se forman, lo cual es debido a que las dimensiones por lo general, tienden a ser estables entre miembros de la misma especie [1].
Las poblaciones microbianas en medios de cultivos pueden presentar distintos comportamientos de crecimiento, lo cual por lo general es representado en muchas ocasiones mediante una curva en la que se distinguen cuatro fases: latencia (hay aumento de volumen, pero las bacterias no se dividen); la fase exponencial o logarítmica (las células empiezan a duplicarse a un ritmo constante); la estacionaria (el número de células no cambia, es decir, que nace la misma cantidad de individuos que muere) y la de declinación o muerte (el número de células muertas supera a las vivas, con lo cual hay decrecimiento en la población) [1,2].
En base al crecimiento exponencial del cultivo microbiano, se dice que la velocidad de incremento de bacterias en un tiempo dado es proporcional al número de bacterias presentes, con lo cual se obtienen ciertos parámetros de estudios, como el de la constate de velocidad de crecimiento k, que está estipulada como k = n/t (log(N) – log(N0)/ log(2)(t-t0)= k), y el tiempo generacional g (1/k=g), que es el tiempo requerido para que todos los componentes bacterianos del cultivo aumenten en un factor de 2 [3].
En estas ecuaciones (de k o g) es necesario saber las concentraciones de las bacterias en distintos intervalos de tiempo, pudiendo estas obtenerse a través de técnicas como la turbidimetría, en la cual se mide la absorbancia de una suspensión dada (mide tanto células viables como no viables), la cual es función de la concentración de la sustancia (en este caso el microorganismo) en la muestra [4].
También se pueden determinar las concentraciones mediante conteo en placas, en las cuales se toma en cuenta el número de unidades formadoras de colonias (UFC) presentes en la superficie de siembra después de un lapso de tiempo determinado (permite diferenciar células vivas de las muertas) [1].
La bacteria Escherichia coli (E. coli) es un microorganismo perteneciente a la familia Enterobacteriaceae [5]. Es un bacilo Gram negativo recto, no esporulador, usualmente móvil (mediante flagelos perítricos), que crece óptimamente a 37 ºC y a pH neutro [6]. Se sabe además que en condiciones óptimas su tiempo generacional es de 21 min [7]. Un aspecto clave a considerar durante el estudio del crecimiento bacteriano, es que su comportamiento puede variar según cambios en las condiciones estándares (por lo general 37 ºC y pH 7), es así como modificaciones en la temperatura, pH, salinidad del medio, la presencia u ausencia de 02, la fuente de carbono y otros factores como la acción de antibióticos, pueden ocasionar una disminución o aumento en el crecimiento poblacional [1,8].
En el presente estudio, se describe el proceso de determinación del crecimiento de E. coli mediante turbidimetría y siembra en placa. También se evalúa la influencia del pH, la temperatura, la salinidad, la ausencia de 02, lactosa como fuente de carbono, la acción de SDS (detergente) y de la amoxicilina (antibiótico) en el crecimiento de dicha bacteria. Se construyeron las curvas de crecimiento para cada caso y se determinó el tiempo generacional para la muestra de E. coli.
2. MATERIALES Y MÉTODOS
Se emplearon métodos en turbidimetría y conteo en placa, de una muestra problema (MP).
2.1. Preparación de MP
Se tomó 1 ml de inóculo de un cultivo con crecimiento de E. coli y se colocó en 70 ml de caldo nutritivo.
2.2. Determinación del crecimiento bacteriano por turbidimetría
Se midió la absorbancia a 540 nm en el espectrofotómetro (marca Thermo Scientific GENESYS 10UV-Vis) de las distintas siembras de 100μl de E. coli bajo diferentes factores físicos y químicos, cada 30 min por un lapso de tiempo de 6 horas. Estos factores fueron:
- MP a 37 ºC y pH7 (Estándar).
- A 25 ºC, en un medio con pH 7.
- A 55 ºC, en un medio con pH 7.
- A 37 ºC, en un medio con pH 3.
- A 37 ºC, en un medio con pH 9.
- A 37 ºC, en un tubo tapado (ausencia de O2).
- A 37 ºC, en un medio con NaCl al 5%.
- A 37 ºC, en un medio con SDS al 5% (detergente).
- A 37 ºC, en un medio con Amoxicilina (1mg/ml).
- A 37 ºC, en un medio con lactosa como fuente de carbono.
2.3. Determinación del crecimiento bacteriano por siembra en placa
A la muestra MP bajo condiciones estándares (37 ºC, pH 7) se le realizaron diluciones consecutivas 1/10, hasta llegar a una dilución de 10-5 (en volúmenes finales de 5 ml). Después de esto se tomaron 100 μl de las últimas dos diluciones (10-4 y 10-5) y se sembraron en una placa con agar, mediante rastrillado. Este procedimiento se realizó cada 30 min durante 5 horas.
2.4. Determinación del tiempo generacional
El tiempo generacional se calculó empleando el método de McFarland, en el cual la curva del mismo nombre, aportó la ecuación para relacionar la absorbancia medida en el espectrofotómetro con la concentración bacteriana (fig.1).
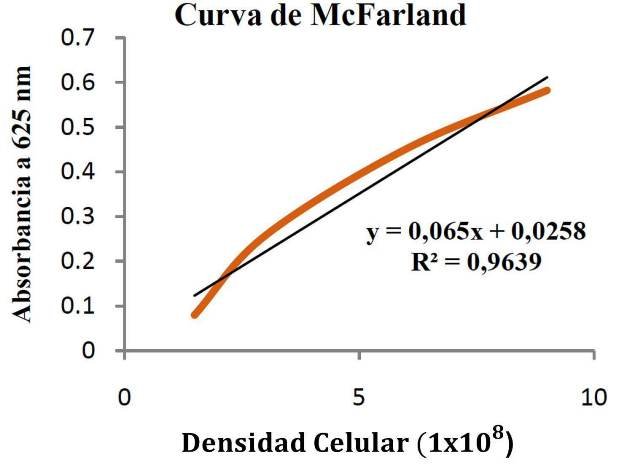
Figura 1: Curva de McFarland [9] para calcular la densidad celular aparente.
3. RESULTADOS
Se construyeron las curvas de crecimiento de E. coli en distintas condiciones mediante turbidimetría para evaluar el efecto de cada una y calcular el tiempo generacional, son brevemente descritas a continuación y reportadas como absorbancia vs tiempo en minutos.
3.1. Curva de crecimiento estándar por turbidimetría
Las absorbancias medidas permitieron la construcción de la curva de crecimiento de E. coli en condiciones estándares (fig. 2). Se observa la fase de latencia entre los 0 y los 100 minutos, después de este tiempo, solo se detalla la fase exponencial. No se observa fase estacionario ni de muerte.
3.2. Crecimiento estándar de por siembra en placa
Se calcularon las unidades formadoras de colonias por ml en base a las colonias contadas en la lupa. No se observa una tendencia clara de aumento o disminución y no fue posible el conteo a partir de los 160 min (Tabla I).
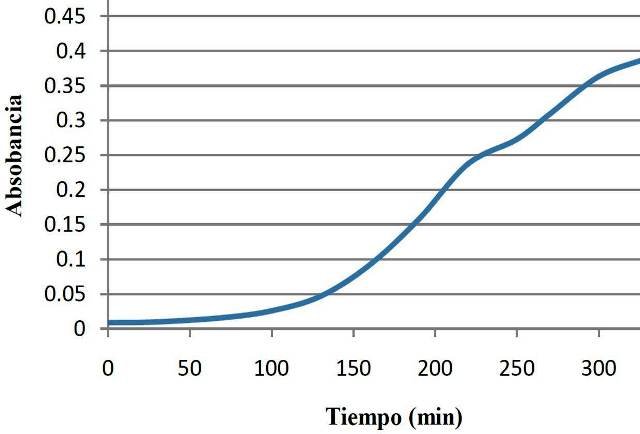
Figura 2: Curva de crecimiento de E. coli a 37 ºC y pH.
Tabla I: Unidades de E. coli formadoras de colonia por ml en condiciones estándares; (-) no se pudo contar las colonias o no había crecimiento.
| Tiempo (min) | UFC/ml |
|---|---|
| 0 | 7x106 |
| 30 | 1x106 |
| 70 | 101x106 |
| 100 | 11,4x106 |
| 130 | - |
| 160 | - |
| 190 | - |
| 220 | - |
| 250 | - |
| 270 | - |
3.3. Tiempo generacional estándar
En base al factor de McFarland y a la curva del mismo nombre, se determinó que el tiempo de generación estándar para E. coli según los datos tomados en fase exponencial fue de aproximadamente 23 min (ver anexos).
3.4. Curva de crecimiento a 25 y 55 ºC
Las curvas se comportaron de manera diferente a ambas temperaturas. El crecimiento en el cultivo a 55 ºC se comportó de manera similar a una constante. A 25 ºC si se detalló una fase exponencial que aparece aproximadamente a partir de los 150 minutos (fig.3).
3.5. Curva de crecimiento a pH 3 y 9
A pH 3 casi no se evidencia aumento en la absorbancia, lo que indica que el microorganismo no crece a una alta tasa, mientras que en pH 9 se observó un muy leve crecimiento (fig.4).
3.6. Curva de crecimiento con presenciade lactosa y ausencia de oxigeno
Las curvas de crecimiento de la E. coli en ausencia de O2 y en presencia de lactosa (fig. 5), indican como disminuyó la velocidad. En la lactosa no solo se retarda el crecimiento de la bacteria sino que después de los 250 min ya se acentúa una fase de muerte o decrecimiento.
3.7. Curva de crecimiento con NaCl 5%, SDS 5% y Amoxicilina 1mg/ml
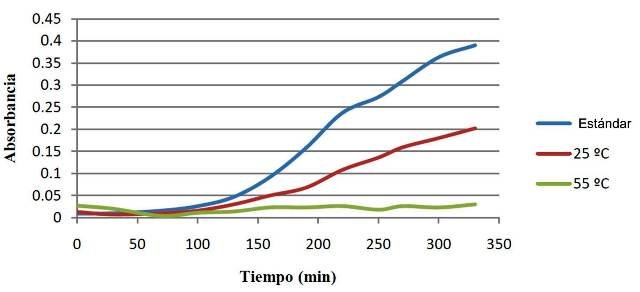
Figura 3: Crecimiento de E. coli a 25 ºC, a 55 ºC y en condiciones estándar.
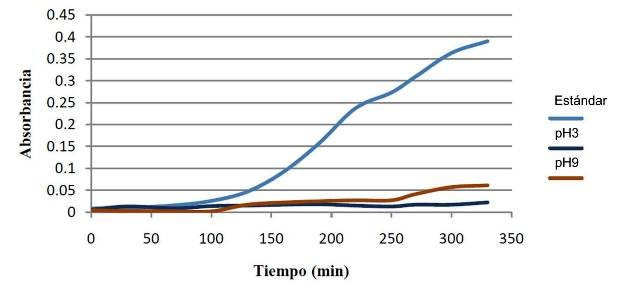
Figura 4: Crecimiento de E. coli a pH 3, 9 y 7 (estándar).
Los factores externos, como la concentración de sales (NaCl), la presencia de SDS (Dodecilsulfato de Sodio) y la Amoxicilina, tienen impactos negativos sobre la velocidad de crecimiento de la E. coli (fig. 6), impidiendo el crecimiento exponencial de la bacteria, en especial las condiciones de NaCl al 5%, que es el factor en el que menos se aumentó la concentración de bacterias durante las 6 horas.
4. DISCUSIÓN
4.1. Crecimiento estándar por turbidimetría y tiempo generacional
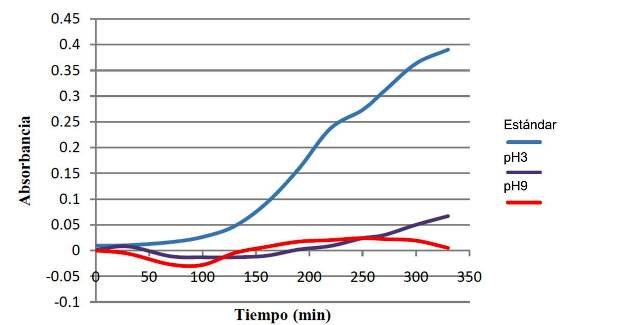
Figura 5: Crecimiento de E. coli en un medio con lactosa, un medio sin oxígeno y un medio estándar.
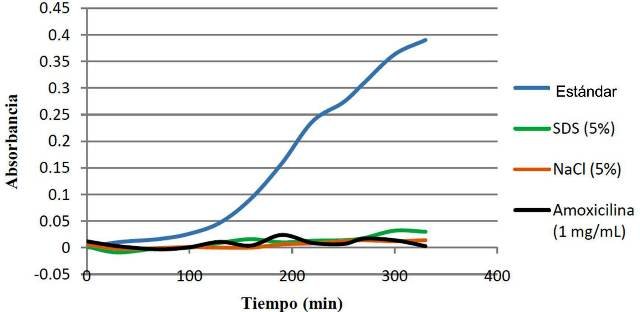
Figura 6: Crecimiento de E. coli en un medio con SDS , un con NaCl, un medio estándar y un medio con Amoxicilina.
Según se pudo observar (fig. 2), entre los 0 y los 100 minutos el crecimiento fue casi nulo, siendo esta la fase estacionaria, fase en la cual las células están sintetizando nuevos componentes, pues fueron inoculadas en un nuevo medio. De 100 min en adelante se observa un crecimiento exponencial, el cual constituye la fase del mismo nombre, siendo esta en la cual los microorganismos crecen y se dividen hasta el nivel máximo posible [5]. Entre los 250 y los 300SDS (5%) minutos se observaron fluctuaciones, estas se dieron pues se dejó el frasco inoculado fuera de la estufa, es decir, se dejó a 25 ºC, lo cual hizo que el microorganismo creciera más lento por no encontrarse a la misma temperatura que en el resto de las mediciones.
El tiempo generacional, se define como el tiempo que tarda una célula en generar dos [10], y para E. coli en condiciones estándar es 21 minutos [7], bastante cercano al valor calculado mediante el método de McFarland y los datos experimentales, 23 minutos. Dicho método, consiste usan como referencia una suspensión turbia para saber, mediante comparación, el número de bacterias por mililitro, o más bien en UFC/ml según una escala que va de 0.5 a 10. Estos estándares son creados al mezclar soluciones de cloruro de bario al 1% con ácido sulfúrico al 1% en volúmenes específicos, y para asegurar la densidad correcta se controla usando espectrofotómetros [9]. Se puede evidenciar que el protocolo de experimentación era y se realizó correctamente, de manera que se obtuvo un valor muy cercano al valor teórico-real. Se mide el tiempo generacional empleando los datos de la fase exponencial pues es en esta cuando las células se encuentran reproduciéndose a su máxima capacidad, y se encuentran fisiológicamente sanas [10].
4.2.Crecimiento estándar en placa
Como se detalló (Tabla I), el crecimiento fue muy inconsistente, razón por la cual fue imposible determinar la curva de crecimiento en condiciones estándares. En algunas placas la densidad era tanta que fue imposible contar las colonias y otras no fueron extendidas correctamente durante el sembrado. Sin embargo, el mayor causante de tal inconsistencia pudo haber sido el hecho de que no se realizaron más diluciones conforme aumentaba la población microbiana a lo largo del tiempo.
4.3. Crecimiento a 25 y 55 ºC
Las enzimas, encargadas de catalizar todos los procesos metabólicos de los microorganismos, poseen una temperatura óptima de funcionamiento, si dicha temperatura es cambiada, la actividad enzimática se verá afectada en cierto grado, pues la temperatura rompe o desnaturaliza las proteínas al dañar los puentes de hidrógeno y disulfuro en las estructuras secundaria y terciaria [11] disminuyendo así la velocidad del crecimiento bacteriano, tal como se observa en la curva obtenida (fig.3). El crecimiento a 55 ºC fue aun menor que el crecimiento a 25 ºC, esto se puede explicar ya que la diferencia entre la temperatura optima de crecimiento de E. coli (37 ºC [6]) y los 55 ºC es de 18 unidades, en comparación con 15 unidades en los 25 ºC.
4.4. Crecimiento a pH 3 y 9
El pH afecta también la actividad enzimática de las bacterias, lo que ocurre es que los aminoácidos que forman las proteínas que conforman enzimas, poseen grupos ionizables, lo cuales participan en los enlaces peptídicos [11]. Si se aumenta o disminuye el pH en relación con el pH óptimo (neutro en este caso [6]) entonces se romperán dichos enlaces, y las enzimas se verán afectadas. El efecto neto, es que se disminuye la velocidad del crecimiento.
La diferencia de pH 7 a pH 3 es mucho mayor que a 9, es por esto que a pH 3 prácticamente no se observa tendencia de crecimiento, en comparación con el pH 9 en el cual si bien no creció tan rápido como la estándar, el crecimiento fue aun así mayor que al pH más ácido.
4.5. Crecimiento con presencia de lactosa y con ausencia de oxígeno
En ausencia de O2 si hay crecimiento bacteriano debido a que E. coli es una bacteria anaerobia facultativa [6], pero el crecimiento no es el mismo que en condiciones estándar, debido a que esta bacteria trabaja mejor en presencia de O2, ya que es en estas condiciones cuando se produce mayor energía en el metabolismo de la bacteria, debido a que en la respiración aeróbica el potencial de reducción de los aceptores de electrones en la cadena transportadora de electrones es mayor que en la respiración anaeróbica en el cual el O2 no es el aceptor final de electrones sino otras moléculas con potencial de reducción menor [8]. Otro aspecto a considerar, es que la molécula aceptora de electrones de la respiración anaeróbica debe provenir del medio en el que se encuentra la bacteria, con lo cual hay un consumo mayor de nutrientes para producir una menor cantidad de energía; y es por eso que en anaerobiosis la fase de latencia es más prolongada, porque se necesita mayor cantidad de nutrientes para producir la energía necesaria para que empiece la división celular.
En presencia de la lactosa ocurre algo parecido en el crecimiento de E. coli, ya que estas fermentan la lactosa, pero más lento que otras moléculas como la glucosa, debido a que necesitan más enzimas para degradarla (por ser un disacárido), lo que explica que se prolongó la fase de latencia en la curva, ya que tardaron más en obtener los nutrientes necesarios de la lactosa [12].
4.6. Crecimiento en NaCl, SDS y Amoxicilina
Estos factores influyeron de tal forma a la bacteria que inhibieron el crecimiento de E. coli, casi desde el tiempo 0. Las altas concentraciones de NaCl, propiciaron la formación de un medio hipertónico, que ocasionó la perdida de agua de la de la célula de la bacteria deshidratándola por osmosis, en la cual se trataban de igualar las concentraciones de sal del medio intracelular y extracelular [1]. Esto se ve en la curva, ya que una vez que se aumenta un poco la concentración de la bacteria, esta se mantiene constante, lo que indica que ya no quedaban células vivas ya que estas murieron por deshidratación o que se llegó a un punto de equilibrio dinámico en la cual la cantidad de células que nacían era la misma cantidad que moría. El SDS también inhibió el crecimiento de la bacteria, ya que este es un detergente aniónico [8], que provoca una gran disrupción de la membrana de la bacteria alterando la disposición ordenada de los lípidos y proteínas presentes, lo cual ocasiona una lisis en la célula de la bacteria. La amoxicilina, es bactericida y actúa inhibiendo la biosíntesis del mucopéptido de la pared celular bacteriana, por lo cual impidió el crecimiento de E. coli ya que esta es muy sensible a este antibiótico. A pesar de esto, el agente tardo en inhibir el crecimiento de E. coli lo cual pudo deberse a la concentración de antibiótico empleado (1 mg/ml), ya que en las suspensiones utilizadas en algunos estudios es de 25 y 50 mg/ ml [13,14].
5. CONCLUSIONES
• La fase estacionaria de la muestra empleada dura entre 0 y 100 minutos en condiciones estándares. A partir de ese momento, las bacterias empezaron a crecer exponencialmente.
• El método de McFarland es un bastante preciso para la medición de la concentración bacteriana. El tiempo generacional calculado para la muestra fue de 23 minutos.
• Durante el plaqueo para la determinación de crecimiento bacteriano, se debe extender bien el inóculo sobre la muestra, para que esta crezca uniformemente y se puedan contar las colonias.
• En necesario aumentar el número de diluciones antes de sembrar en placa si el microorganismo está creciendo.
• La temperatura afecta el crecimiento bacteriano, a 25 y 55 ºC, la muestra de E. coli crece lentamente en comparación con el crecimiento a 37 ºC. A 25 ºC es menos lento y la población microbiana tiene más tendencia a aumentar.
• El pH afecta la velocidad de crecimiento del microorganismo en cuestión. A pH 3 E. coli prácticamente no crece y a pH 9 crece levemente, ambas en comparación con la estándar.
• Una solución de NaCl al 5% es efectiva para retardar y prácticamente inhibir el crecimiento de la muestra de E. coli.
• El SDS al 5% y la Amoxicilina (1 mg/ml) necesitan encontrarse a mayor concentración para retardar el crecimiento de la muestra bacteriana de manera significativa o definitiva.
6. REFERENCIAS BIBLIOGRÁFICAS
[1] Negroni M. Microbiología Estomatológica. 2da edición. Buenos Aires: Edición Medica Panamericana S.A; 2009. p 656.
[2] Granados P, Villaverde M. Microbiología. Madrid: Ediciones Paraninfo, S.A; 2003. p 352.
[3] Villanueva J. Microbiología. 2da edición. España: Editorial Reverte, S.A; 1996. p 768.
[4] Pickering K. Química Analítica Moderna. Barcelona: Editorial Revete, S.A; 1980. p 688.
[5] Prescott L, Harley J, Donald K. Microbiología. 4ta edición. Madrid: McGraw Hill- Interamericana; 2000. Pp 1005.
[6] Sussman M. Escherichia coli: mechanisms of virulence. Cambridge: Cambridge University Press; 1997. p 643.
[7] Cortés D. Biologia: diccionarios. Oxford University Press; 2004. p 719.
[8] Tortora G, Funke B, Case C. Introducción a la Microbiología. Madrid: Editorial Médica Panamericana, S.A; 2007. p 959.
[9] Koneman I. Diagnóstico microbiológico: téxtos y atlas en color. 6ta edición. Madrid: Editorial Médica Panamericana, S.A; 2006. p 1634.
[10] BROCK, Madigan M, Martinko J, Parker J. Biología de los microorganismos. Décima edición. Madrid: Pearson; 2003. p 1111.
[11] Lehninger A. Bioquímica: las bases moleculares de la estructura y función celular. 2da edición. Barcelona: Ediciones Omega, S.A.; 1978. p 1117.
[12] González F, González R, Triana- Alonso. Influencia de las hormonas tiroxina, insulina, glucagón y cortisol en el crecimiento y expresión genética de escherichiacoli en medio de cultivo líquido. BIOMED-UC. 2011: 1(1): 30-37.
[13] Andreu A, Alós J, Gobernado M, Marco F, de la Rosa M, García- Rodríguez. Etiology and antimicrobial susceptibility among uropathogens causing community-acquired lower urinary tract infections: a nationwide surveillance study. Enferm Infecc Microbiol Clin. 2005: 23(1): 4-9.
[14] Sánchez M, Guillán M, Fuster C, Madrid FJ, Jiménez M, García J. Microbial sensitivity of Escherichia coli in community-acquired urinary tract infections. Actas Urol Esp. 2003: 27(10): 783-7.
Anexos
En base a la curva de McFarland:
𝐴𝑏𝑠𝑜𝑟𝑏𝑎𝑛𝑐𝑖𝑎 = 0,065𝑥 + 0,0258
Tomando las absorbancias a los 130 y 190 minutos de cultivo (inicio de la fase exponencial):
Absorbancia0 = 0,047 a los 130 min y Absorbancia1 = 0,158 a los 190 min
𝑥 = (Absorbancia − 0,0258)/0,065
X0= 0,32615385x108
X1=2,03384615x108
Para calcular la constante de velocidad de crecimiento (k):
k = Log N1 − Log((N0))/Log(2)Δt
k= (Log(2,03384615x108) − Log(0,32615385x108))/Log(2) (190 – 130)
k= 0,0440097807
Finalmente el tiempo generacional (g):
g = 1/k
g= 22,72222835
g≈23 minutos
El inóculo inicial a sembrar fueron 0,1ml a partir de un cultivo diluido (1/105 o 1/104). En la placa de tiempo 0, por ejemplo, se contaron 7 colonias en la dilución 1/105.
UFC/ml = (7colonias 105)/ 0,1ml =7x106 UFC/ml
Congratulations @khrisaeroth! You have completed the following achievement on Steemit and have been rewarded with new badge(s) :
<p dir="auto"><a href="http://steemitboard.com/@khrisaeroth" target="_blank" rel="noreferrer noopener" title="This link will take you away from hive.blog" class="external_link"><img src="https://images.hive.blog/768x0/https://steemitimages.com/70x80/http://steemitboard.com/notifications/votes.png" srcset="https://images.hive.blog/768x0/https://steemitimages.com/70x80/http://steemitboard.com/notifications/votes.png 1x, https://images.hive.blog/1536x0/https://steemitimages.com/70x80/http://steemitboard.com/notifications/votes.png 2x" /> Award for the number of upvotes <p dir="auto"><sub><em>Click on the badge to view your Board of Honor.<br /> <sub><em>If you no longer want to receive notifications, reply to this comment with the word <code>STOP <p dir="auto"><strong><span>Do not miss the last post from <a href="/@steemitboard">@steemitboard:<br /> <a href="https://steemit.com/steemitboard/@steemitboard/steemitboard-world-cup-contest-the-results-and-prizes" target="_blank" rel="noreferrer noopener" title="This link will take you away from hive.blog" class="external_link">SteemitBoard World Cup Contest - The results, the winners and the prizes <blockquote> <p dir="auto">Do you like <a href="https://steemit.com/@steemitboard" target="_blank" rel="noreferrer noopener" title="This link will take you away from hive.blog" class="external_link">SteemitBoard's project? Then <strong><a href="https://v2.steemconnect.com/sign/account-witness-vote?witness=steemitboard&approve=1" target="_blank" rel="noreferrer noopener" title="This link will take you away from hive.blog" class="external_link">Vote for its witness and <strong>get one more award!This post has been voted on by the steemstem curation team and voting trail.
There is more to SteemSTEM than just writing posts, check here for some more tips on being a community member. You can also join our discord here to get to know the rest of the community!
Hi @khrisaeroth!
Your post was upvoted by utopian.io in cooperation with steemstem - supporting knowledge, innovation and technological advancement on the Steem Blockchain.
Contribute to Open Source with utopian.io
Learn how to contribute on our website and join the new open source economy.
Want to chat? Join the Utopian Community on Discord https://discord.gg/h52nFrV